신약 바이오벤처 올릭스(226950)가 비대흉터 치료 신약 OLX101A(물질명 OLX10010)의 임상2상 시험계획(IND) 신청서를 미국 식품의약국(FDA)에 제출했다고 25일 공시했다.
이번 2a임상에서는 흉터 재건술을 시행한 환자를 대상으로 OLX10010 피내 투여시 비대 흉터의 재발 억제효과와 안전성 평가가 진행된다. 임상은 미국 내 5개 시험기관에서 치러진다.
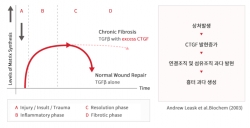
지난 2018년 범부처신약개발사업단의 국가연구개발사업으로 선정된 OLX101A는 비대흉터를 치료하기 위한 신약후보물질이다. 비대흉터는 외과적 수술·외상 후 상처 부위가 회복되는 과정에서 발생하며, 진피층의 콜라겐이 과다하게 증식하면서 결정형태로 튀어나와 비정상적인 흉터를 생성하는 증상이다. 현재까지 치료제로 승인받은 전문의약품이 없어 의학적 미충족 수요가 높은 질환으로 알려져 있다.
선민정 하나금융투자 연구원은 "임상 2상에서 효능이 입증된다면 비대칭형 siRNA 플랫폼 기술에 대한 가치는 크게 증가하면서 올릭스의 기업가치 또한 레벨업 될 수 있을 것으로 기대된다"고 밝혔다.
올릭스는 이외에도 자체 보유한 3세대 신약개발 기술 RNAi 플랫폼 특허를 활용해 난치성 질환 치료제 개발을 진행하고 있다. 현재 전문치료제가 없거나 충분하지 않은 건성황반변성, 망막하 섬유화증, 특발성폐섬유화 등이 그 대상이다.
저작권자 © 더스탁(The Stock) 무단전재 및 재배포 금지

